Les équilibres chimiques
I. L'équilibre acido-basique
- Notion d'équilibre chimique
Transformation entre un acide faible et l'eau : AH + H2O A- + H3O+
Elle estdite limitée, ce qui se traduit par la présence des espèces AH et A- à l'état final. Lors d'une transformation limitée, on dit que le système est dans un état d'équilibre chimique lorsque les concentrations n'évoluent plus. La transformation résulte de deux réactions inverses l'une de l'autre. Les équations correspondantes sont écrites avec le signe
L'équilibre chimique est un état d'équilibre dynamique car les réactions inverses se produisent simultanément mais à la même vitesse.
- Constante d'acidité
La constante d'acidité de la réaction de l'acide AH avec l'eau est appelée constante d'acidité du couple AH(aq) / A-(aq), elle est notée Ka et ne dépend que de la température. L'équation de
la réaction est : AH + H2O A- + H3O+
Elle vaut :
Ka= ([A-].[H3O+]) / [AH] (Il s'exprime sans unité)
Les concentrations ici exprimées sont les concentrations à l'état final.
- Echelle des pKa dans l'eau
Le couple est également défini par son pKa = -log Ka
Un acide est d'autant plus fort qu'il donne des ions H3O+ et donc plus un acide est fort, plus Ka est grand et pKa petit.
- Déplacement d'équilibre
Si on modifie la concentration d'une des espèces appartenant à l'équilibre chimique, le système évolue vers un nouvel état d'équilibre qui tend à s'opposer à cette modification. Si on ajoute de l'eau, l'équilibre se déplace dans le sens (1), si on consomme des molécules AH, l'équilibre se
déplace dans le sens (2)
AH + H2O <--> A- + H3O+ 1 : vers la droite 2 : vers la gauche
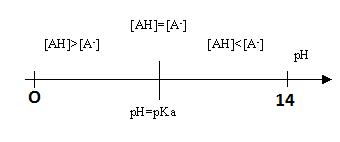
- Diagramme de prédominance
Relation entre les concentrations et le pH :
Ka = ([A-].[H3O+]) / [AH] --> log Ka = log ([A-].[H3O+]) / (AH) = log [H3O+] + log
[A-] / [AH] = -pH + log [A-] / [AH]
Comme pKa = -log Ka, on obtient pH= pKa + log [A-] / [AH]
Si pH=pKa alors log [A-] / [AH] =0, soit [A-] / [AH] =1 = 100 car log 100=0, l'acide A- et la base A- ont la même concentration.
Si pH<pKa alors log [A-] / [AH] <0, soit [A-] / [AH] <1, l'acide AH à une concentration
supérieure que celle de la base A-. L'acide prédomine : [AH]> [A-]
Si pH>pKa alors log [A-] /[AH] >0, soit [A-] / [AH] >1, la base A- à une
concentration supérieure que celle de l'acide AH. La base prédomine : [AH]< [A-]
Le diagramme de prédominance représente les zones de pH ou les espèces d'un couple prédominent.
Un indicateur coloré est constitué d'un couple acide/base dont les deux espèces conjuguées ont des teintes différentes.
L'équilibre chimique : AH + H2O <--> A- + H3O+ est caractérisé par sa constante d'équilibre Ka, et les concentrations [AH] et [A-] sont liées par la relation :
pH= pKa + log [A-] / [AH]
Pour pH<pKa -1, l'indicateur coloré a sa teinte acide
Pour pH>pKa +1, l'indicateur coloré a sa teinte basique
La zone de virage est un intervalle de pH encadrant le pKa sur lequel l'indicateur coloré a sa teinte sensible.
II. pH et milieux biologiques
- Solution tampon
On appelle solution tampon une solution dont le pH varie peu par addition d'une petite quantité d'acide ou de base et par dilution modérée.
Une solution tampon est constituée d'un mélange en proportion voisines d'un acide faible et de sa base conjuguée. Le pH contrôlé est alors proche du pKa du couple.
- Importance du contrôle du pH en milieu biologique
L'activité enzymatique, les processus biochimiques des organismes vivants ne sont possibles que dans des domaines de pH limités.
Le pH du sang est maintenu au voisinage de 7,4 grâce à un ensemble de solutions tampons. Le contrôle du pH est fondamental pour de nombreux milieux biologiques.
